1月6日,中国科学院上海营养与健康研究所钱友存研究组在Nature Immunology上发表题为“The IL17REL gene encodes a decoy receptor of IL-17 family cytokines to control gut inflammation ”的研究论文。该研究揭示了人源IL-17受体家族新成员IL-17REL在炎症性肠病(Inflammatory bowel disease,IBD)中的重要保护作用,并明确了其在IBD易感性中的关键功能。研究发现,IL-17REL可作为一种特异性的内源性“诱饵受体”(decoy receptor),通过竞争性阻断IL-17家族细胞因子与其经典受体的结合,从而抑制IL-17信号通路的激活及下游炎症相关基因的表达,进而限制肠道炎症反应并抑制IBD的发生与发展。
炎症性肠病是一类发生于肠道的慢性炎症性疾病,主要包括克罗恩病(Crohn’s disease, CD)与溃疡性结肠炎(Ulcerative colitis,UC)。IBD的发病率在全球范围内持续上升,已逐渐成为严重威胁人类健康的公共卫生问题。流行病学与遗传学研究提示,遗传易感性与多种环境因素的共同作用是IBD发生发展的重要基础。为系统解析遗传因素在IBD中的作用,大量基于全基因组关联分析(Genome-wide association study,GWAS)及外显子测序的遗传学研究已鉴定出超过240个与IBD相关的单核苷酸多态性(Single nucleotide polymorphism,SNP)位点。然而,绝大多数IBD相关遗传位点的功能尚不清楚,这些变异是否直接参与IBD的病理过程及其具体分子机制仍有待进一步系统研究。
IL17REL是由GWAS发现的一个IBD相关基因,经预测其编码蛋白与IL-17RE相似,但其是否可以被转录成mRNA并被翻译成蛋白尚不得而知。研究团队通过对IBD患者组织样本进行系统分析,结合RNA原位杂交和免疫组织化学等手段,首次证实IL17REL可在巨噬细胞、T细胞和B细胞等免疫细胞中被诱导表达,并进一步明确了转化生长因子β(TGFβ)在其诱导表达中的关键作用。
尽管IL-17REL蛋白缺乏经典信号肽序列,研究发现其可依赖于ATP-P2RX7-GSDMD通路释放至胞外。胞外IL-17REL以浓度依赖的方式竞争性结合IL-17RA所识别的多种IL-17配体成员,包括IL-17A、IL-17C和IL-17F,从而显著抑制IL-17信号下游炎症因子基因(如 IL1B、IL6、CXCL1 和 CXCL2)的表达。此外,人源IL-17REL蛋白与小鼠来源的IL-17A、IL-17C及IL-17F之间表现出较强的交叉结合能力。在体内实验中,人源IL17REL基因敲入小鼠可显著缓解TNBS诱导的小鼠结肠炎病理表现。
基于此前遗传学研究已发现IL17REL存在两个与IBD显著相关的单核苷酸多态性(SNP)突变位点,研究人员进一步通过功能实验验证了这些突变的致病机制。体外实验表明,突变型IL-17REL蛋白显著丧失了与IL-17A、IL-17C和IL-17F的结合能力,并失去了对IL-17信号通路的拮抗作用。在体内模型中,携带突变型IL17REL基因的敲入小鼠(hIL17RELG70R/L333P-KI)完全丧失了野生型IL-17REL在TNBS诱导性结肠炎中的保护效应。在此基础上,研究团队进一步评估了IL-17REL重组蛋白的治疗潜力。结果显示,系统性给药野生型IL-17REL蛋白能够显著改善TNBS诱导的小鼠结肠炎,而突变型IL-17REL蛋白则不具备治疗效果。
研究团队长期从事IL-17家族细胞因子及其受体的研究,取得一系列研究成果(Nat. Immunol. 2011; Nat. Med. 2012; Immunity 2014, 2015, 2019)。本研究首次鉴定并系统阐明了IL-17家族的诱饵受体IL-17REL,解析了其表达调控机制及免疫功能,并明确其功能性突变是IBD的重要遗传致病因素之一。这一发现不仅为深入理解IBD的发病机制提供了新的理论框架,也为开发靶向IL-17信号通路的创新治疗策略提供了全新的潜在靶点。
中国科学院上海营养与健康研究所钱友存研究员及杨涛副研究员为该论文的共同通讯作者,博士后李琦为论文第一作者。该工作得到了同济大学附属第十人民医院刘占举教授,中国科学院分子细胞科学卓越中心宋昕阳研究员等的宝贵支持。该研究得到国家自然科学基金和科技部国家重点研发计划等项目支持。
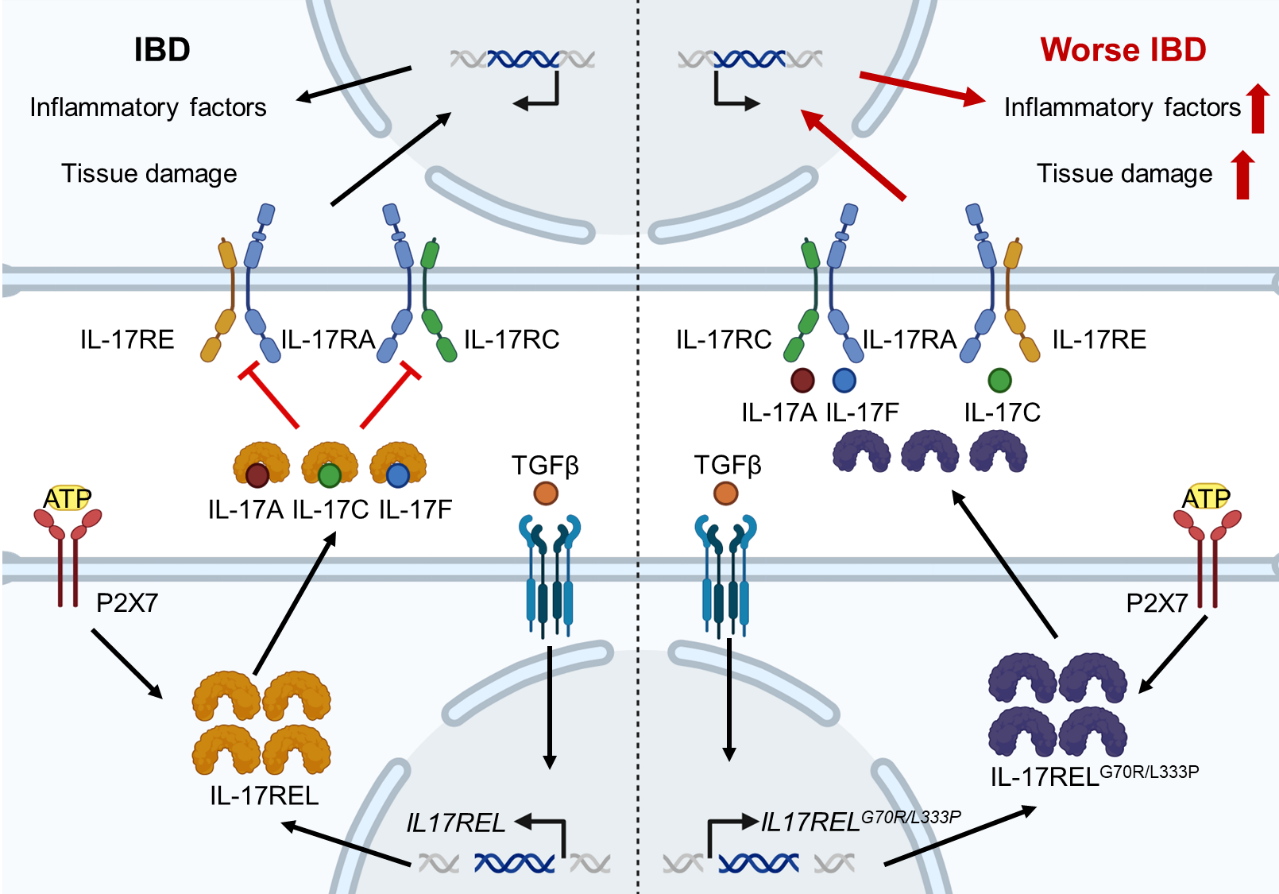
图:野生型而非突变型IL-17REL蛋白通过竞争性结合IL-17配体成员并抑制下游基因表达以实现治疗炎症性肠病效果
原文链接:https://www.nature.com/articles/s41590-025-02368-4
推送单元:钱友存研究组、科技规划与任务处