4月3日,中国科学院上海营养与健康研究所陈雁研究组在国际学术期刊American Journal of Physiology-Endocrinology and Metabolism 在线发表了题为“Glycogen synthesis is required for adaptive thermogenesis in beige adipose tissue and affects diet-induced obesity” 的研究论文。该研究发现,脂肪组织中的糖原合成酶1 (GYS1) 调节脂肪组织糖原水平,并由此调节米色脂肪组织的适应性产热,从而影响饮食诱导的肥胖。
糖原是葡萄糖残基的分支聚合物。糖原的代谢包括糖原的合成和降解,主要受激素以及糖原合成酶(GS)和糖原磷酸化酶(GP)两种关键酶的控制。GS通过催化α-1-4糖苷键的形成,在糖原链上添加新的葡萄糖,在糖原合成的最后一步中起着关键作用。在哺乳动物中,GS有两种亚型:GYS1和GYS2,分别由Gys1和Gys2基因编码。Gys2仅在肝脏中发现,而Gys1在许多不同的组织中表达,如肌肉和脂肪。尽管与肌肉和肝脏相比,脂肪细胞中的糖原水平较低,但近年来人们开始认识到它在调节糖脂代谢协调中的重要性。脂肪细胞的适应性产热因其在对抗肥胖方面的潜在应用而成为近年来研究的热点。当受到冷暴露或儿茶酚胺刺激时,β3肾上腺素能受体被激活,进而导致下游cAMP-PKA信号转导和UCP1表达激活,从而增加能量消耗。
该研究利用一个脂肪组织特异性Gys1敲除的小鼠模型,探讨了糖原在能量代谢和适应性产热中的作用。发现在长期的肾上腺素能激活的过程中,糖原在脂肪组织中积累。Gys1缺乏不影响正常饮食小鼠的代谢和产热,且不影响小鼠在6小时急性冷刺激中的耐寒性。然而,在长时间冷刺激或肾上腺素能激活的条件下,Gys1缺失会抑制米色脂肪组织的适应性产热,表现为UCP1表达降低,米色脂肪组织的脂质积累增加。此外,Gys1缺失加重了饮食性肥胖,并伴有葡萄糖耐受等其他代谢紊乱。值得注意的是,与野生型小鼠相比,Gys1敲除小鼠在喂食高脂饮食后,氧气消耗和二氧化碳排放都有所减少,这表明脂肪组织中糖原合成的不足,能够降低小鼠的基础代谢率,而代谢率的降低可能导致Gys1缺失小鼠体重增加。同样,Gys1敲除抵消了β3肾上腺素能受体激动剂导致的体重降低。上述研究结果进一步证实了糖原合成在米色脂肪适应性产热及饮食诱导肥胖中的重要作用。
这一研究突出了糖原在肥胖和适应性产热中的重要性,提示靶向糖原代谢可能是未来对抗肥胖的一个潜在策略。
营养与健康所陈雁研究员为该论文的通讯作者,博士研究生卓士铉为该论文的第一作者。该研究得到了国家自然科学基金委的资助,同时得到营养与健康所所级公共技术中心分析测试技术平台、实验动物技术平台的支持。
文章链接:
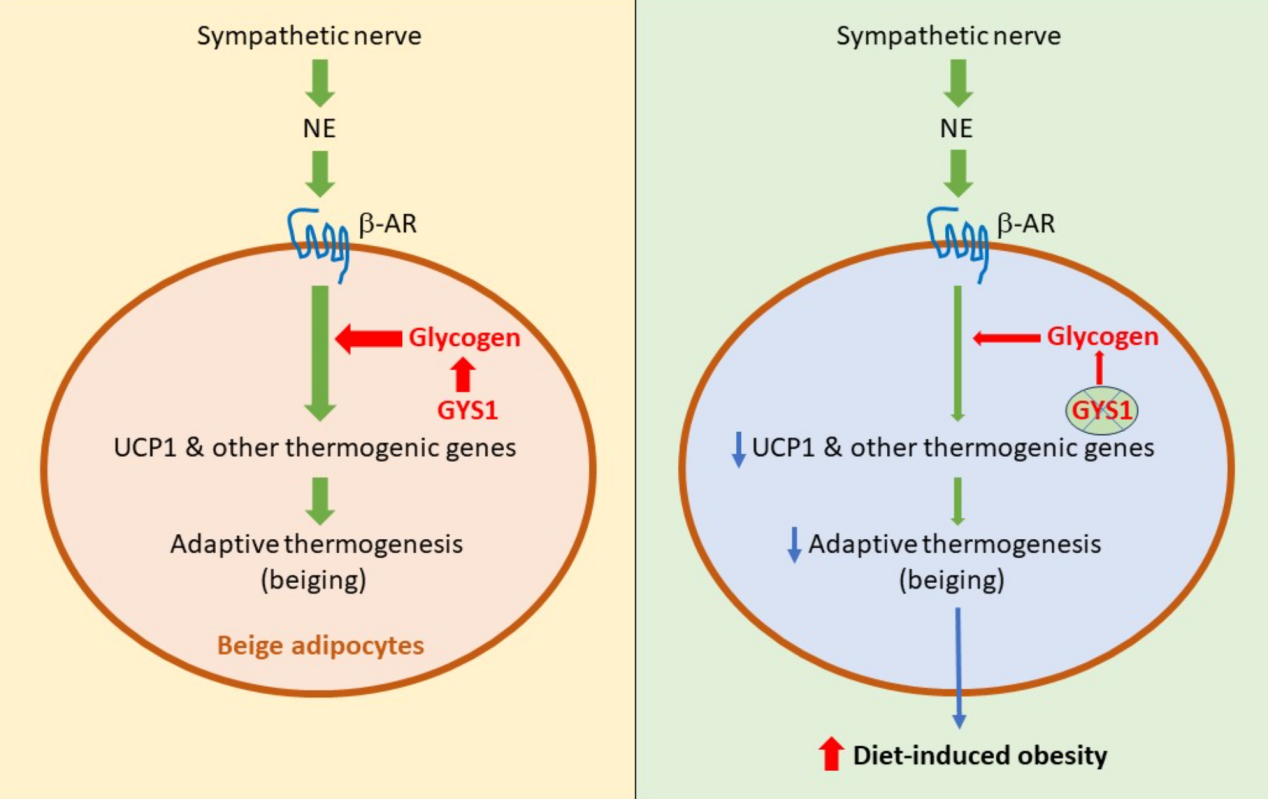
脂肪糖原合成影响米色脂肪适应性产热和饮食诱导的肥胖