中国科学院上海营养与健康研究所、西南医科大学附属医院研究人员首次阐明葡萄糖作为信号分子对脂肪细胞能量代谢的转录调控机制,揭示了CREB/ATF碱性亮氨酸拉链转录因子(CREBZF)是脂肪细胞感知葡萄糖信号通路中的关键因子。该研究成果于2024年4月8日在《美国科学院院刊》(PNAS)在线发表。
脂肪组织在机体维持物质及能量代谢稳态过程中发挥重要作用。白色脂肪细胞可将过剩能量进行储存,棕色及米色脂肪细胞则可通过产热作用帮助机体维持体温。脂肪产热过程可消耗大量能量,因此激活脂肪细胞的产热能力可能是解决能量过剩造成肥胖及相关代谢问题的重要途径。葡萄糖是脂肪细胞产热过程中的重要供能物质,然而葡萄糖在被细胞摄入后是否能作为信号分子参与调控产热过程并不清楚。
为了探究葡萄糖在脂肪组织产热过程中的调控作用,研究人员将处于饥饿状态的小鼠置于4℃低温环境诱导脂肪组织产热程序,发现葡萄糖注射显著增强小鼠体温维持能力,并且特异性促进皮下米色脂肪细胞产热相关基因的表达。此外,发现体外葡萄糖处理显著增强小鼠原代脂肪细胞及细胞系中产热基因的表达,表明葡萄糖作为信号分子参与产热基因的转录调控,并且CREBZF的蛋白水平同样受葡萄糖信号诱导增加。
研究人员进一步发现葡萄糖信号通过乙酰基转移酶CBP/p300对CREBZF蛋白赖氨酸208位点进行乙酰化修饰,增强CREBZF的蛋白稳定性;相反,去乙酰化酶HDAC3则可去除该位点的乙酰基团,进而降低细胞内CREBZF的蛋白含量。此外,葡萄糖激活的CREBZF与下游产热调控关键因子PGC-1α结合,抑制其转录活性,从而发挥对脂肪细胞产热能力的抑制作用。
在低温条件对CREBZF脂肪特异性敲除小鼠给予葡萄糖后,敲除小鼠的产热能力及体温进一步增加,表明CREBZF受葡萄糖信号激活后,可能帮助脂肪组织的能量代谢状态稳定在较高水平,同时避免过度能量消耗造成组织损伤。生理条件下,葡萄糖诱导的CREBZF可能防止米色脂肪细胞过度激活与不必要的能量消耗;而病理条件下,葡萄糖诱导的脂肪细胞CREBZF激活可能是造成高血糖与肥胖条件下机体产热能力受损的重要原因。
总之,该研究揭示葡萄糖作为信号分子参与脂肪细胞产热的作用机制。脂肪细胞CREBZF能够介导葡萄糖信号,进而调节能量代谢信号通路,在葡萄糖感应过程中发挥重要作用;CREBZF对葡萄糖感应的失调在能量过剩造成的肥胖及相关代谢疾病发生发展中发挥关键作用。
中国科学院上海营养与健康研究所李于研究员,西南医科大学附属医院徐勇教授为本论文通讯作者,中国科学院上海营养与健康研究所副研究员崔奥媛、博士研究生苏维彤与薛雅倩为本论文共同第一作者。该研究得到国家科技部重点研发计划、国家自然科学基金委、上海市市级重大专项、代谢性血管疾病四川省重点实验室开放课题的资助,同时得到中国科学院上海营养与健康研究所所级公共技术中心的支持。
研究论文链接:https://doi.org/10.1073/pnas.2318935121
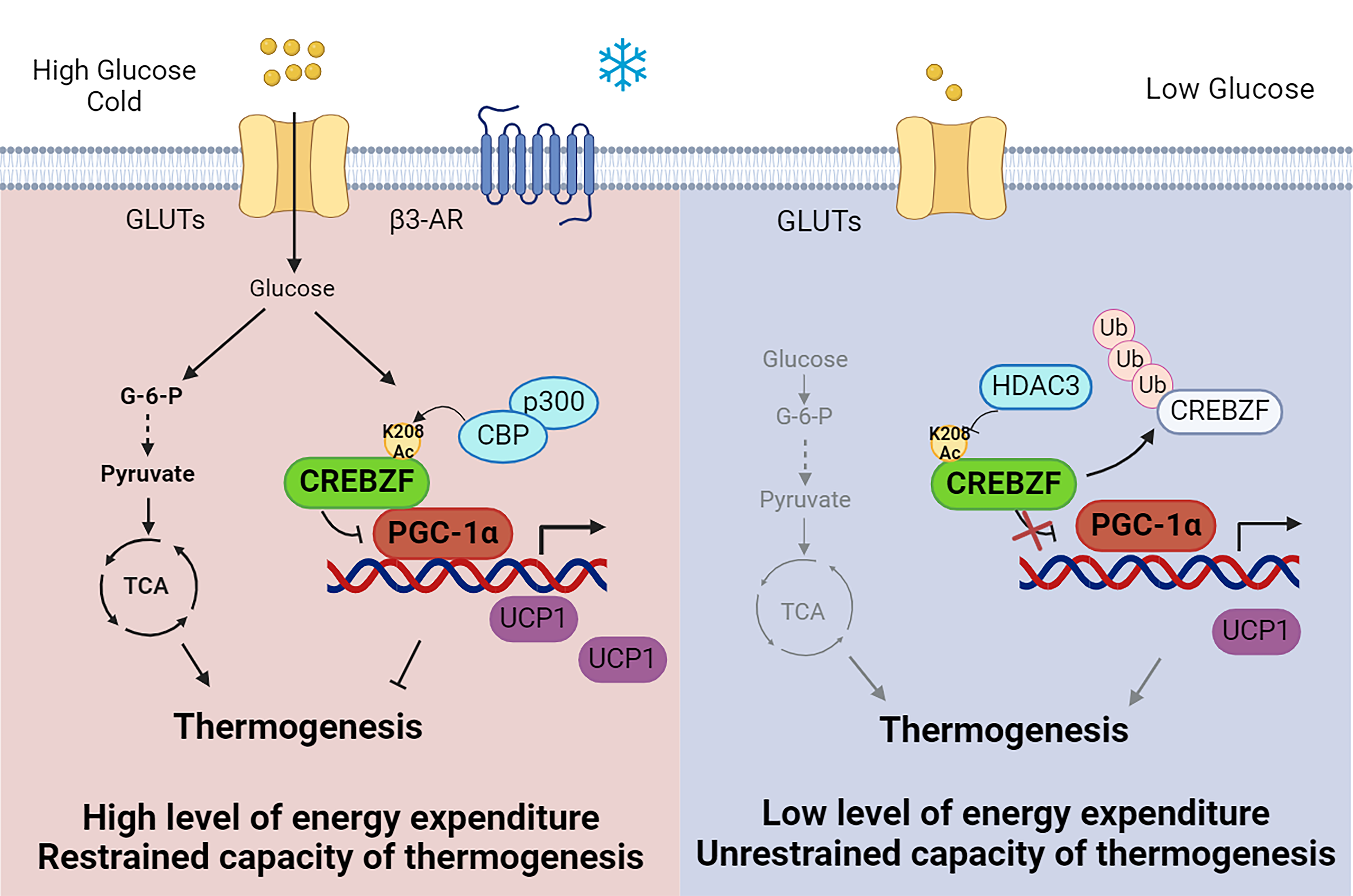
脂肪细胞CREBZF介导葡萄糖信号调节产热过程的模式图
(在低温及环境信号刺激时,脂肪细胞将大量摄取葡萄糖,一方面可作为供能物质直接为脂肪细胞提供能量,另一方面,葡萄糖信号通过CBP/p300增加CREBZF乙酰化修饰及蛋白稳定性,CREBZF将与PGC-1α结合抑制产热相关基因表达,限制脂肪细胞对能量过度消耗。本研究表明CREBZF是感知葡萄糖信号通路中的关键因子,CREBZF对葡萄糖感应的失调,在能量过剩造成的肥胖及相关代谢疾病发生发展中发挥重要作用)